Le principe d'Aufbau est la méthode de base qui nous indique comment les électrons sont remplis dans l'orbitale atomique. Selon le principe d'Aufbau, le remplissage des électrons dans l'état fondamental d'un atome suit un modèle de base. Ce principe nous dit que les électrons de l’orbitale atomique de tout atome sont remplis dans l’ordre croissant de leur énergie et que pour trouver l’énergie de l’orbitale atomique, ils suivent la règle n+l.
Principe structurel
dijkstra
Dans cet article, nous découvrirons en détail le principe d'Aufbau, les caractéristiques du principe d'Aufbau, ses exceptions et ses limitations.
Définition du principe de structure
Le principe d’Aufbau stipule que
Les électrons des différentes orbitales sont remplis dans l’ordre croissant de leur énergie, c’est-à-dire que l’orbitale avec l’énergie la plus basse sera remplie en premier et celle avec l’énergie la plus élevée sera remplie en dernier.
Le mot « Aufbau » en allemand signifie « Construire ». La formation d’orbitales signifie remplir les orbitales d’électrons. Il indique que les électrons des orbitales atomiques sont remplis dans l’ordre croissant de l’énergie de l’orbitale atomique. Et l'énergie de l'orbitale atomique est calculée à l'aide de la règle n+l qui indique si l'électron avec un nombre plus élevé de valeur n+l a l'énergie la plus élevée. Dans la règle discutée à la ligne précédente, n indique le nombre quantique principal et je indique le nombre quantique azimutal.
Si deux électrons ont la même valeur de n+l alors l’électron avec une valeur plus petite de n a la plus petite énergie et est rempli en premier. L’ordre de remplissage des électrons dans une orbitale atomique est discuté ci-dessous.
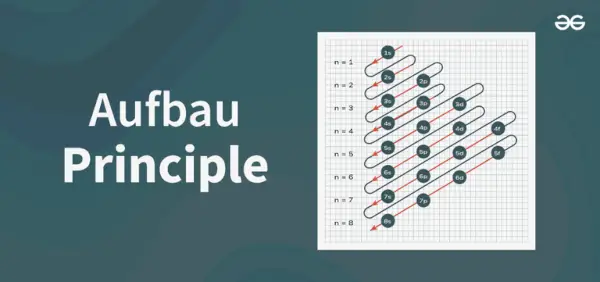
Structure du diagramme de principe
Le diagramme de principe d'Aufbau est le diagramme qui décrit l'ordre de remplissage des électrons dans un atome.
Structure du diagramme de principe
Structure de la formule principale
La formule du principe d'Aufbau est la formule qui indique l'ordre dans lequel les électrons sont remplis dans l'orbitale atomique. La formule de l'orbitale atomique est
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Structure de la classe de principes 11
Le principe d'Aufbau est un principe important de chimie pour les étudiants de la classe 11. Ce principe stipule que,
Les électrons de l'orbitale atomique d'un atome sont remplis dans l'ordre croissant de l'énergie de l'orbitale atomique qui est calculée à l'aide de la règle (n+l).
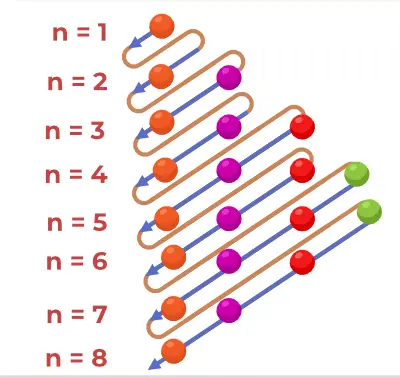
Dessiner le schéma de structure
Le diagramme Aufbau est dessiné en suivant les étapes ajoutées ci-dessous,
- Trouvez le nombre d’électrons qui doivent être remplis dans les atomes.
- Nous savons que dans un atome
- L'orbitale s peut contenir un maximum de 2 électrons.
- L'orbitale p peut contenir un maximum de 6 électrons.
- L'orbitale d peut contenir un maximum de 10 électrons.
- L'orbitale f peut contenir un maximum de 14 électrons.
- Remplissez les deux premiers électrons de l’orbitale 1s.
- Suivez ensuite la règle n+l, puis remplissez les électrons en conséquence.
Principales caractéristiques du principe de structure
Diverses caractéristiques du principe Aufbau sont,
- L'énergie d'une orbitale dépend de la somme des valeurs du nombre quantique principal (n) et du nombre somme azimutal (I). C'est ce qu'on appelle le (n + l) règle . Selon cette règle,
- Dans un atome neutre isolé, plus la valeur de (n + l) pour une orbitale est faible, plus son énergie est faible. Cependant, si deux types d’orbitales différents ont la même valeur (n + l), alors les orbitales avec une valeur inférieure de n ont moins d’énergie.
| Type d'orbitale | Valeur de n | Valeur de l | Valeur de n+l | Énergie relative |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Énergie la plus basse |
| 2s | 2 | 0 suppression de la liste de tableaux | 2+0 = 2 | Énergie supérieure à 1 s orbitale |
| 14h 3s | 2 flux de filtre Java 3 | 1 0 | 2+1 = 3 3+0 = 3 | Les orbitales 2p (n = 2) ont une énergie inférieure à l'orbitale 3s (n = 3). |
| 15h 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Les orbitales 3p (n = 3) ont une énergie inférieure aux orbitales 4s (n = 4). |
| 3D 16h | 3 en quelle année l'ordinateur a-t-il été inventé 4 | 2 1 | 3+2 = 5 4+1 = 5 | Les orbitales 3D (n = 3) ont une énergie inférieure aux orbitales 4p (n = 4). |
De la description donnée dans le tableau, il résulte que les énergies des différentes orbitales augmentent avec l'augmentation du nombre du nombre quantique principal.
- Ainsi, l'ordre dans lequel les électrons sont remplis dans l'orbitale atomique du atome est, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Configuration électronique utilisant le principe d'Aufbau
Le configuration électronique l'utilisation du principe d'Aufbau pour quelques éléments est discutée ci-dessous :
Configuration électronique du soufre
Numéro atomique du soufre vaut 16, c'est-à-dire qu'il possède 16 électrons
Maintenant, en utilisant le principe d'Aufbau, la configuration électronique du Sulphur s'écrit comme suit :
[S] = 1 s 2 2s 2 14h 6 3s 2 15h 4
Configuration électronique de l'azote
Le numéro atomique de l’azote est 7, c’est-à-dire qu’il possède 7 électrons
Maintenant, en utilisant le principe d'Aufbau, la configuration électronique de l'azote s'écrit comme suit :
[N] = 1 s 2 2s 2 14h 3
Exceptions au principe de construction
Il existe quelques exceptions au principe Aufbau qui sont le chrome et le cuivre. Leur configuration électronique est,
java codage if else instruction
Configuration électronique de Chrome
La configuration électronique de Chromium selon le principe Aufbau doit être
- Cr(24) : [Ar]3d 4 4s 2
Mais la configuration ci-dessus n'est pas correcte car la configuration électronique réelle de Chrome(Cr) est,
- Cr(24) : [Ar]3d 5 4s 1
La raison de cette configuration électronique est que le L'orbitale atomique D à moitié remplie est plus stable que l'orbite remplie selon le principe d'Aufbau.
Configuration électronique du cuivre
La configuration électronique du cuivre selon le principe Aufbau doit être,
- Cu(29) : [Ar]3d 9 4s 2
La configuration ci-dessus n'est pas correcte car la configuration électronique réelle du cuivre (Cu) est,
- Cu(29) : [Ar]3d dix 4s 1
La raison de cette configuration électronique est que le L'orbitale atomique D entièrement remplie est plus stable que l'orbite remplie selon le principe d'Aufbau.
En savoir plus
- Nombres quantiques
- Forme des orbitales atomiques
- Structure atomique
Principe de structure – FAQ
Qu’est-ce que le principe d’Aufbau en chimie ?
Le principe d'Aufbau en chimie est le principe de base utilisé pour remplir les électrons dans les orbitales atomiques de n'importe quel atome. Ce théorème nous indique l'ordre dans lequel les électrons sont remplis dans l'orbitale atomique.
Qui a donné le principe d’Aufbau ?
Le principe d'Aufbau a été énoncé par le célèbre physicien danois Niels Bohr en 1920.
Quel est le principe d’exclusion de Pauli ?
Le principe d’exclusion de Pauli stipule que dans un atome, il n’y a pas deux électrons qui possèdent les quatre nombres quantiques. t il pareil. Au moins, l'un des nombres quantiques est différent pour tous les électrons de l'atome.
Qu’est-ce que la règle n+l ?
La règle n+l est la règle qui stipule que l'énergie d'une orbitale dépend de la somme du nombre quantique principal (n) et du nombre quantique azimutal (l). cette règle est appelée la règle (n+l).
Quelles sont les exceptions au principe Aufbau ?
Les exceptions au principe Aufbau sont :
- Configuration électronique du chrome Cr[24]
- Configuration électronique du cuivre Cu[29]
