Orbitales atomiques , qui sont des fonctions mathématiques, décrivent le comportement ondulatoire des électrons (ou des paires d'électrons) dans un atome. Les orbitales atomiques ont des formes différentes selon leur type. Les différentes formes d’orbitales atomiques indiquent qu’il existe une probabilité soit la plus élevée, soit nulle de trouver un électron autour du noyau dans certaines directions. Il existe quatre types d'orbitales, chacune ayant une forme différente et représentée par les lettres s, p, d et f. Les orbitales s et p sont prises en compte car elles sont les plus abondantes en chimie chimique et biologique. Un orbitale S a un noyau sphérique au centre, un p-orbitale est en forme d'haltère, et quatre des cinq d orbitales sont en forme de trèfle. La cinquième orbitale D a la forme d’un long haltère avec un beignet au centre. Les orbitales d'un atome sont organisées en couches ou couches électroniques.
Que sont les orbitales atomiques ?
Les orbitales atomiques sont l'espace tridimensionnel proche du noyau d'un atome où la possibilité de découvrir un électron est maximale.
Un atome, selon le modèle atomique quantique, peut avoir un nombre infini d’orbitales. Ces orbitales peuvent être classées en fonction de leur taille, de leur forme ou de leur orientation. Une orbitale plus étroite signifie qu’il y a une meilleure probabilité d’attraper un électron proche du noyau. La fonction d'onde orbitale est souvent connue comme une fonction mathématique utilisée pour exprimer les coordonnées d'un électron. La probabilité de localiser un électron est représentée par le carré de la fonction d’onde orbitale. Cette fonction d'onde facilite également la création de diagrammes de surfaces limites.
Fonction d'onde orbitale
Le modèle atomique quantique prédit qu’un atome peut avoir une grande variété d’orbitales. Ces orbitales peuvent être regroupées selon leur taille, leur géométrie ou leur inclinaison. Une taille orbitale réduite augmente la probabilité d’obtenir un électron proche du noyau. La fonction mathématique utilisée pour représenter les coordonnées d’un électron est appelée fonction d'onde orbitale . La probabilité de découvrir un électron est représentée par le carré de la fonction d’onde orbitale.
Nous pouvons également utiliser cette fonction d’onde pour créer des diagrammes de surfaces limites. Nous pouvons mieux comprendre la forme des orbitales en utilisant des diagrammes de surfaces limites de densité de probabilité constante pour diverses orbitales.
sqrt java mathématiques
Formes des orbitales atomiques
Les formes des orbitales atomiques varient. C’est-à-dire que les distributions de probabilité des électrons qu’ils décrivent entourant le noyau sont différentes. Le fait que les électrons des différentes orbitales soient susceptibles d’être situés dans des zones différentes autour du noyau parent et subissent donc l’attraction de ce dernier avec des forces variées est l’une des raisons pour lesquelles les orbitales varient en énergie. Il est étonnant que toutes les orbitales d’une coquille donnée de l’atome d’hydrogène aient la même énergie tout en ayant des formes variées. Cela est dû à la suppression de diverses contributions liées à l’énergie.
Mais dès qu’il y a un deuxième électron, la dégénérescence disparaît.
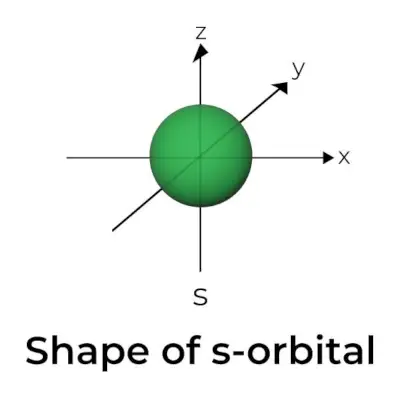
Forme de l'orbitale S
- Le diagramme de la surface limite de l'orbite s ressemble à une sphère avec le noyau en son centre, qui peut être représenté en deux dimensions sous la forme d'un cercle.
- Les orbitales s sont à symétrie sphérique, ce qui signifie que la probabilité de trouver un électron à une distance donnée est la même dans toutes les directions.
- Il est également démontré que la taille de l'orbitale s augmente à mesure que la valeur du nombre quantique primaire (n) augmente ; par conséquent, 4s> 3s> 2s> 1s.
- Le point nodal est un endroit où il n’y a aucune chance de localiser l’électron. Les nœuds sont classés en deux types : les nœuds radiaux et les nœuds angulaires. La distance au noyau est calculée par les nœuds radiaux, tandis que l'orientation est déterminée par les nœuds angulaires.
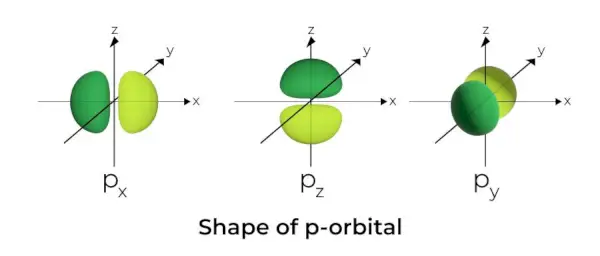
Forme de l'orbitale p
- Les orbitales p sont formées comme des haltères.
- Le nœud orbital p est situé au centre du noyau.
- En raison de la présence de trois orbitales, l’orbitale p peut occuper un maximum de six électrons.
- Chaque orbitale p est composée de deux parties appelées lobes situées de chaque côté du plan qui traverse le noyau.
- Chaque orbitale p comporte des parties appelées lobes de chaque côté du plan qui traverse le noyau. Au plan d’intersection des deux lobes, la probabilité de trouver un électron est nulle.
- Les trois orbitales sont appelées orbitales dégénérées car elles ont la même taille, la même forme et la même énergie.
- La seule différence entre les orbitales est l'orientation des lobes. Parce que les lobes sont orientés le long de l'axe x, y ou z, on leur donne les noms 2px, 2py, et 2pz. La formule n –2 est utilisée pour calculer le nombre de nœuds.
- De la même manière que pour les orbitales s, la taille et l'énergie des orbitales p augmentent à mesure que le nombre quantique primaire augmente (4p> 3p> 2p).
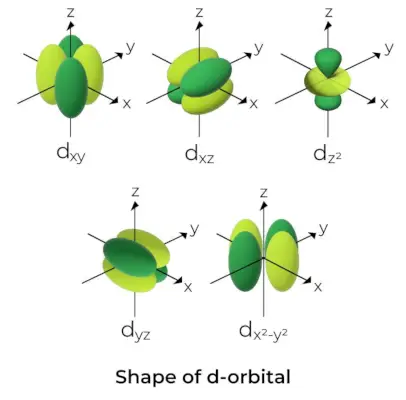
Forme de l'orbitale D
- Pour les orbitales d, le nombre quantique de l'orbite magnétique est donné par (-2,-1,0, 1,2). En conséquence, nous pouvons affirmer qu’il existe cinq orbitales d.
- Ces orbitales sont désignées par les symboles dxy, douais, dxz, dX2-et2, et dAvec2.
- Les formes des quatre premières orbitales d sont similaires les unes aux autres, ce qui diffère de la dAvec2orbitale, mais l'énergie des cinq orbitales d est la même.
Forme de l'orbitale f
- La forme de l’orbitale f est dispersée. Parce que la valeur de l = 3 pour l'orbitale f, la valeur minimale du nombre quantique primaire n est 4.
- Les valeurs ml équivalentes pour l'orbitale f sont (-3, –2, –1, 0, +1, +2, +3).
- En conséquence, il existe sept orbitales f pour l = 3.

exemple de nom d'utilisateur
Orbitales dégénérées
Les orbitales dégénérées sont celles qui ont la même énergie. Ces orbitales sont distinctes (elles peuvent être orientées différemment dans l'espace autour du noyau atomique ), pourtant ils ont la même énergie. En présence d'un champ externe, la dégénérescence de l'orbitale p n'est pas affectée ; cependant, la dégénérescence des orbitales f et d peut être interrompue en appliquant un champ externe au système (champ électrique ou magnétique).
Peu d’orbitales auront une énergie plus élevée, tandis que d’autres auront une énergie plus faible. La dégénérescence n’existera plus dans le système. Par exemple, les orbitales d sont constituées de cinq orbitales dégénérées qui ont toutes la même énergie.
En savoir plus:
- Théorie des orbitales moléculaires
- Remplissage d'une orbitale dans un atome
- Hybridation
FAQ sur les formes des orbitales atomiques
Question 1 : Comment fonctionnent les orbitales ?
Répondre:
Une orbitale atomique est une expression mathématique qui exprime le comportement ondulatoire d’un électron ou d’une paire d’électrons dans un atome en théorie atomique et en mécanique quantique. Chaque orbitale occupera un maximum de deux électrons, chacun avec sa propre quantité de spin.
constructeur de chaînes
Question 2 : Qu'est-ce que le plan nodal ?
Répondre:
Le plan où la probabilité de trouver un électron est négligeable ou nulle est appelé plan nodal.
Question 3 : Combien y a-t-il d’orbitales ?
faire et while boucle en java
Répondre:
Comme le sous-niveau s n’a qu’une seule orbitale, seuls deux électrons peuvent être présents. Étant donné que le sous-niveau p comprend trois orbitales, un maximum de six électrons peuvent être présents. Étant donné que le sous-niveau d comprend 5 orbitales, un maximum de 10 électrons peuvent être présents. Et chacun des quatre sous-niveaux possède sept orbitales pouvant contenir un maximum de 14 électrons.
Question 4 : Quelles orbitales ont l’énergie la plus élevée ?
Répondre:
opérateur Java
L’orbitale 1 a le plus d’énergie. L’énergie d’un électron est la quantité d’énergie nécessaire pour le sortir de la bulle électrique de l’atome.
Question 5 : Quelle est la différence entre un obus et une orbitale ?
Répondre:
Dans un atome, une coquille est un ensemble de sous-couches de la même théorie des nombres quantiques, n. Les orbitales ont chacune deux électrons, et les électrons de la même orbitale ont la même définition de taille, de taille de moment cinétique et de nombre quantique magnétique.
Question 6 : Qu'est-ce que la liaison sigma et pi ?
Répondre:
Le chevauchement orbital atomique crée des liaisons sigma et pi. Les liaisons Sigma sont créées par le chevauchement de lobes orbitaux atomiques, tandis que les liaisons Pi sont générées lorsqu'un lobe orbital atomique en chevauche un autre.
