La base est un composé chimique constitué de OH–ions et accepte les protons. Les bases en chimie sont ces composés qui virent au bleu tournesol rouge et qui, lorsqu'ils réagissent avec un acide, neutralisent la réaction pour donner du sel et de l'eau. Le pH de la base est supérieur à 7. Les bases ont un goût amer et un toucher glissant. Les bases solubles dans l’eau sont appelées alcalines. Des exemples de bases sont les oxydes métalliques, les hydroxydes métalliques, etc. Le savon est un exemple de base que nous utilisons dans la vie quotidienne. Dans cet article, nous découvrirons en détail la définition, les propriétés et les réactions chimiques des bases.

Définition de base
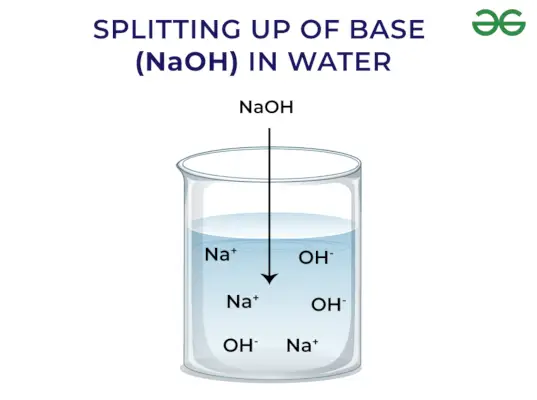
La base est définie comme le composé chimique dont la valeur du pH est supérieure à 7, accepte un proton, neutralise l'acide et transforme le tournesol rouge en bleu. Ils libèrent généralement OH–ion sur la dissociation. Les exemples incluent NaOH, NaHCO3,etc. Voici quelques caractéristiques générales présentées par la base :
- Ils ont un goût amer
- Ils sont glissants au contact
- Ils deviennent bleu tournesol rouge
- Ils libèrent OH–ion lorsqu'il est dissous dans l'eau
- Ils conduisent l'électricité sous forme de solution
Les bases sont l’un des composés chimiques les plus importants utilisés dans la vie quotidienne. Les bases sont utilisées comme antiacide pour contrôler l'acidité et dans les dentifrices pour neutraliser l'action bactérienne qui produit de l'acide dans notre bouche et prévient la dégradation de l'émail et de la carie. Ils sont également utilisés comme levure chimique, bicarbonate de soude et lessive.
Base Lewis
Les bases de Lewis sont les composés qui ont une paire d'électrons et peuvent en faire don aux composés déficients en paires d'électrons. Les bases de Lewis sont de nature nucléophile, c'est-à-dire qu'elles aiment les noyaux, ce qui signifie qu'elles attaqueront un centre chargé positivement avec leurs paires d'électrons. Des exemples de base de Lewis incluent l'ammoniac car dans l'ammoniac (NH3) l'atome central d'azote a 5 électrons dont 3 sont utilisés pour établir des liaisons avec 3 atomes d'hydrogène et une paire d'électrons reste avec l'atome d'azote, formant ainsi NH3une base Lewis.
Base d'Arrhénius
Selon le concept d’Arrhenius, les bases sont des composés qui libèrent des ions hydroxyde lorsqu’ils sont dissous dans l’eau et augmentent la concentration d’ions hydroxyle dans la solution aqueuse. Par exemple, lorsque KOH est dissous dans l’eau, il donnera OH–ion et ainsi augmenter la concentration de OH–dans l'eau.
Base bronzée
Le concept de base de Bronsted est une version avancée du concept d'Arrhenius qui stipule que les bases sont des composés qui acceptent H.+ion ou proton pour former leur acide conjugué. Par exemple Cl–est une base qui accepte H+pour former HCl comme acide conjugué.
Types de socles
Les bases peuvent être classées en fonction de leur acidité, de leur concentration et de leur capacité d'ionisation. Le classement est mentionné ci-dessous
Types de bases basées sur l'acidité
L'acidité d'une base fait référence au nombre de groupes hydroxyles remplaçables présents dans une molécule de la base. En fonction de l'acidité, les bases sont classées en trois catégories :
- Base monoacide
- Base diacide
- Base triacide
Monoacide : Les bases monoacides sont celles qui contiennent un seul ion hydroxyle remplaçable et interagissent avec un seul ion hydrogène. Les bases monoacides comprennent NaOH, KOH et autres.
java xor
Diacide : Une base diacide est une base avec deux ions hydroxyle remplaçables qui interagissent avec deux ions hydrogène. Ca(OH)2, Mg(OH)2, et d'autres bases diacides en sont des exemples.
Triacide : La base triacide est un type de base qui comprend trois ions hydroxyle remplaçables et trois ions hydrogène. Les bases triacides comprennent Al(OH)3, Fe(OH)3, et d'autres.
Types de bases en fonction de leur concentration en solution aqueuse
La concentration fait référence à la quantité de base présente dans une solution aqueuse. En fonction de leur concentration en solution aqueuse, les bases sont divisées en deux catégories :
- Base concentrée
- Base diluée
Base concentrée : Les bases concentrées sont celles dans lesquelles la quantité de base est importante par rapport au solvant. Solution concentrée de NaOH, par exemple.
Base diluée : Ces types de bases ont une concentration plus faible de base dans leur solution aqueuse. La dilution est le processus de réduction du pourcentage d'un soluté en ajoutant une plus grande quantité de solvant. Par exemple, diluez NaOH, diluez KOH, etc.
Types de bases basés sur le degré d'ionisation
Le degré d'ionisation fait référence à la capacité d'un composé chimique à libérer l'ion qui le constitue lorsqu'il est dissous dans l'eau. Dans le cas de la base, le degré d'ionisation fait référence à la capacité de la base à libérer OH–ions lorsqu'ils sont dissous dans l'eau. En fonction du degré d'ionisation, les bases sont classées en deux types :
- Base solide
- Base faible
Base solide : Les bases fortes sont les bases qui se dissocient complètement et libèrent des ions OH- lorsqu'elles sont dissoutes dans l'eau. Quelques exemples de bases fortes incluent NaOH, KOH, etc.
Base faible : Les bases qui ne subissent pas de dissociation complète et ne libèrent qu’une fraction d’ion OH- sont appelées bases faibles. Des exemples de bases faibles incluent Al (OH)3,Cu(OH)2,etc.
Apprendre encore plus, Bases fortes et faibles
travail informatique
Propriétés des bases
Comme nous savons que les bases sont des composés chimiques qui ont un ion OH-, virent au bleu tournesol rouge, etc. Dans cette section, nous découvrirons les propriétés physiques et chimiques des bases ainsi qu'une brève connaissance de leurs propriétés générales.
Propriétés générales de la base
Les propriétés générales des bases sont mentionnées ci-dessous :
- Un ion hydroxyde (OH–) est libéré dans l'eau par les bases. Plus la base devient forte à mesure que davantage d’ions sont libérés.
- Les bases réagissent avec l'acide pour former du sel. Les acides réagissent avec les bases. Cette réaction d’une base avec un acide est appelée réaction de neutralisation.
- Les bases transforment le tournesol rouge en bleu.
- La structure d’une protéine peut être modifiée par les bases. Les bases ont cette qualité, ce qui les rend lisses. Le savon est une base qui devient incroyablement glissante sur votre peau lorsqu'elle est mouillée. En raison de leur capacité à modifier la structure des protéines, certaines bases puissantes sont extrêmement dangereuses.
Propriétés physiques des bases
Les bases ont un goût amer : Les bases ont un goût amer. En raison de son amertume, nous n’avons que peu d’aliments alcalins. Il n'y a que quelques matières alimentaires alcalines. Les bases doivent être dégustées avec plus de prudence que les acides.
Les bases sont glissantes au toucher : Lorsqu'on les touche, les bases sont glissantes. Par exemple du savon.
Libération des bases OH – Ion: Lorsque les bases sont dissoutes dans l'eau, elles libèrent des ions hydroxyle (OH–). En fonction de leur capacité à libérer des ions hydroxyle, ils sont classés comme forts et faibles.
Les bases neutralisent les acides : Lorsque les bases réagissent avec les acides, elles se neutralisent et produisent du sel et de l'eau. Cette réaction est appelée Réaction de neutralisation . Disons que nous avons l’acide HY et la base « XOH », alors le sel formé sera « XY ». L’équation de cette réaction peut être donnée par HY + XOH → HOH + XY.
Les bases dénaturent les protéines : La dénaturation des protéines signifie la destruction de la stabilité et de la structure de la protéine. Cela rend l'utilisation d'une base nocive pour l'homme, car la peau et les cheveux humains sont constitués de protéines et lorsque des alcalis forts tels que l'hydroxyde de sodium ou de potassium, également appelé lessive, sont utilisés, ils créent un impact nocif sur la peau humaine.
Les bases transforment le tournesol rouge en bleu : Lorsque les bases sont mises en contact avec du tournesol rouge, elles le rendent bleu. Cependant, il convient de noter qu’aucun changement de ce type ne peut être observé lorsque nous essayons de faire réagir une base sèche avec du papier de tournesol rouge. Le test Litmus Paper est l’une des méthodes les plus anciennes pour tester une base. Cependant, d’autres indicateurs existent également comme la Phénolphtaléine
Les bases conduisent l’électricité : Lorsque les bases sont sous forme de solution, elles contiennent des ions OH- mobiles et peuvent donc conduire l'électricité.
Propriétés chimiques des bases
- Réaction de la base avec les métaux : Lorsque l’alcali (base) réagit avec le métal, du sel et de l’hydrogène gazeux sont produits.
Alcali + Métal → Sel + Hydrogène
Exemples:
- Lorsque l’hydroxyde de sodium interagit avec l’aluminium métallique, de l’aluminate de sodium et de l’hydrogène gazeux sont générés.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 heures 2
- Lorsque l’hydroxyde de sodium interagit avec le zinc métallique, il produit de l’hydrogène gazeux et du zincate de sodium.
2NaOH + Zn → Na 2 ZnO 2 +H 2
- Réaction des oxydes non métalliques avec la base : Le sel et l'eau se forment lorsque des oxydes non métalliques réagissent avec une base.
Oxyde non métallique + Base → Sel + Eau
Lorsque l'hydroxyde de calcium, une base réagit avec du dioxyde de carbone, du carbonate de calcium et de l'eau sont produits.
Ca(OH) 2 + CO 2 → CaCO 3 +H 2 Ô
- Réaction des alcalis/bases avec les sels d'ammonium : L'ammoniac est produit lorsque les alcalis réagissent avec les sels d'ammonium.
Alcali + Sel d'ammonium → Sel + Eau + Ammoniaque
Lorsque l’hydroxyde de calcium réagit avec le chlorure d’ammonium, de l’eau de chlorure de calcium et de l’ammoniac sont produits.
Ca(OH) 2 + NH 4 Cl → CaCl 2 +H 2 O + NH 3
bonne chance
Exemples de bases
Les bases sont généralement des oxydes métalliques, des hydroxydes métalliques, des hydrogénocarbonates métalliques, des carbonates métalliques, etc. Voyons quelques exemples de bases avec leur application sous forme de tableau :
| Socles | Applications |
|---|---|
| L'hydroxyde de potassium KOH | Utilisé dans les piles alcalines |
| Hydroxyde de sodium NaOH | Utilisé dans la fabrication de savon et de détergent |
| L'hydroxyde de magnésium Mg(OH) 2 liste de tableaux java | Utilisé comme antiacides |
| Bicarbonate de sodium NaHCO 3 | Utilisé comme bicarbonate de soude |
| Le carbonate de sodium Déjà 2 CO 3 | Utilisé comme lessive de soude |
| Ammoniac NH 3 | Utilisé dans la fabrication de produits de nettoyage et pharmaceutiques |
| Hydroxyde de calcium Ca(OH) 2 | Utilisé dans le lavage blanc séquence de fibonacci java |
Utilisations des bases
Il existe différents cas d'utilisation de base, parmi lesquels :
- L'hydroxyde de sodium est utilisé dans la fabrication du savon et du papier. L'hydroxyde de sodium (NaOH) est également utilisé dans la production de rayonne.
- La poudre décolorante est composée de Ca(OH)2, communément appelée chaux éteinte ou hydroxyde de calcium.
- L'hydroxyde de calcium est utilisé pour créer des mélanges secs pour la peinture et la décoration.
- L’hydroxyde de magnésium, communément appelé lait de magnésie, est un laxatif largement utilisé. Il est également utilisé comme antiacide car il diminue l’excès d’acidité dans l’estomac humain.
- Dans les laboratoires, l'hydroxyde d'ammonium est un réactif essentiel.
- La chaux éteinte peut être utilisée pour neutraliser tout excès d’acidité des sols.
En savoir plus
- Acide, base et sel
- Force de l'acide
- Ionisation de l'acide et de la base
FAQ sur les bases en chimie
1. Que sont les bases ?
- Les composés de base ont une saveur amère.
- La texture de la plupart des bases est savonneuse.
- Lorsqu'il est testé sur du papier tournesol, il transforme le papier tournesol rouge en papier tournesol bleu dans la plupart des cas.
- En solution, les composés de base conduisent également l’électricité.
- Lorsque les composés basiques sont dissous dans l’eau, des ions OH- sont libérés.
2. Quelles sont les fonctions des bases ?
À la maison, nous utilisons des bases comme agents nettoyants et antiacides. Les savons, la lessive (utilisée dans les nettoyants pour fours), le lait de magnésie et les Tums sont tous des exemples de bases maison populaires. Chacun d’eux a un pH supérieur à sept, peut consommer de l’hydrogène libre et neutraliser les acides.
3. Quelle est la distinction la plus importante entre un acide et une base ?
Acides et bases sont deux types de produits chimiques corrosifs. Les matériaux acides ont une valeur de pH comprise entre 0 et 7, tandis que les bases ont une valeur de pH comprise entre 7 et 14. Les acides sont des produits chimiques ioniques qui se décomposent dans l'eau pour créer l'ion hydrogène (H+) tandis que la base se dissocie pour donner l'ion OH-.
4. Quelles sont les propriétés physiques des bases ?
- Ils ont un goût amer.
- Leurs solutions aqueuses ont une qualité savonneuse.
- Ils changent la couleur du papier tournesol du rouge au bleu.
- Leurs solutions aqueuses sont électriquement conductrices.
- Avec la libération d’hydrogène gazeux, les bases réagissent avec les métaux pour générer du sel.
5. Que se passera-t-il lorsque l’hydroxyde de calcium réagit avec le chlorure d’ammonium ?
Lorsque l’hydroxyde de calcium réagit avec le chlorure d’ammonium, de l’eau de chlorure de calcium et de l’ammoniac sont produits.
Ca(OH) 2 + NH 4 Cl → CaCl 2 +H 2 O + NH 3
6. Que se passera-t-il lorsque l'hydroxyde de sodium réagit avec le zinc métallique ?
Lorsque l’hydroxyde de sodium interagit avec le zinc métallique, il produit de l’hydrogène gazeux et du zincate de sodium.
2NaOH + Zn → Na 2 ZnO 2 +H 2
7. Qu'est-ce que la base Lewis ?
Les bases de Lewis sont les composés qui donnent une paire d'électrons au composé déficient en électrons. L'exemple inclut NH3.
8. De quoi sont faites les bases ?
Les bases sont généralement constituées de OH–ion. Outre ces oxydes métalliques, les carbonates et les hydrogénocarbonates sont également des bases.
9. Que sont les alcalis ?
Les bases solubles dans l’eau sont appelées alcalines. Un exemple est l’hydroxyde de sodium NaOH.
10. Que sont une base forte et une base faible ?
Les bases qui se dissocient complètement pour donner OH–Les ions qui se dissolvent dans l'eau sont appelés bases fortes. Les exemples incluent NaOH. Les bases faibles sont celles qui ne se dissocient pas complètement pour libérer OH–L’ion est appelé base faible. Des exemples de bases faibles incluent l’hydroxyde d’ammonium.
