Le Tableau périodique d’éléments est un arrangement systématique de 118 éléments chimiques connus. Ces éléments chimiques sont organisés par ordre de numéro atomique croissant. Les lignes horizontales de gauche à droite sont appelées périodes tandis que les colonnes verticales de haut en bas sont appelées groupes dans un tableau périodique.
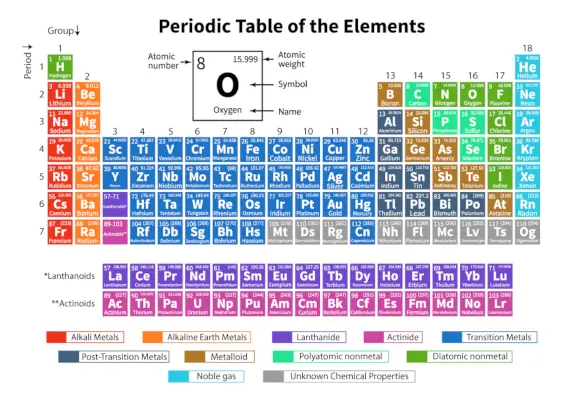
Table des matières
- Qu'est-ce que le tableau périodique ?
- Liste des éléments du tableau périodique
- Termes importants dans le tableau périodique
- Classification des éléments dans le tableau périodique
- Tableau périodique de Mendeleïev
- FAQ sur le tableau périodique des éléments
Qu'est-ce que le tableau périodique ?
Un tableau périodique est une représentation tabulaire dans laquelle tous les éléments chimiques connus sont disposés en lignes horizontales appelées périodes et en colonnes verticales appelées groupes en fonction de leur numéro atomique et la structure atomique respectivement.
Il s'agit d'un arrangement de tous les éléments connus et fournit donc des informations sur les éléments telles que leur masse, leur nombre d'électrons, leur configuration électronique et leurs propriétés chimiques uniques.
Liste des éléments du tableau périodique
Voici le tableau représentant 118 éléments du tableau périodique. Les éléments répertoriés sont classés selon l’ordre croissant du numéro atomique et leur poids atomique, leur symbole, leur densité et leur électronégativité respectifs.
| Éléments du tableau périodique avec masse atomique | |||||
|---|---|---|---|---|---|
| Numéro atomique | Nom de l'élément chimique | Symbole | Masse atomique (amu) | Densité (g/cm 3 ) | Électronégativité |
| 1 | Hydrogène | H | 1.0079 | 0,00008988 | 2.2 |
| 2 | Hélium | Il | 4.0026 | 0,0001785 | – |
| 3 | Lithium | Que | 6 941 | 0,534 | 0,98 |
| 4 | Béryllium | Être | 9.0122 | 1,85 | 1,57 |
| 5 | Bore | B | 10 811 | 2.34 | 2.04 |
| 6 | Carbone | C | 12.0107 | 2 267 | 2,55 |
| 7 | Azote | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Oxygène | Ô | 15.9994 | 0,001429 | 3.44 |
| 9 | Fluor | F | 18.9984 | 0,001696 | 3,98 |
| dix | Néon | Oui | 20.1797 | 0,0009002 | – |
| onze | Sodium | Déjà | 22.9897 | 0,968 | 0,93 |
| 12 | Magnésium | Mg | 24 305 | 1 738 | 1.31 |
| 13 | Aluminium | Au | 26.9815 | 2.7 | 1,61 |
| 14 | Silicium | Ouais | 28.0855 | 2 329 | 1.9 |
| quinze | Phosphore | P. | 30.9738 | 1 823 | 2.19 |
| 16 | Soufre | S | 32 065 | 2.07 | 2,58 |
| 17 | Chlore | Cl | 35 453 | 0,0032 | 3.16 |
| 18 | Argon | Avec | 39 948 | 0,001784 | – |
| 19 | Potassium | K | 39.0983 | 0,89 | 0,82 |
| vingt | Calcium | Que | 40 078 | 1,55 | 1 |
| vingt-et-un | Scandium | Sc | 44.9559 | 2 985 | 1,36 |
| 22 | Titane | De | 47 867 | 4 506 | 1,54 |
| 23 | Vanadium | DANS | 50.9415 | 6.11 | 1,63 |
| 24 | Chrome | Cr | 51.9961 | 7h15 | 1,66 |
| 25 | Manganèse | Mn | 54 938 | 7.21 | 1,55 |
| 26 | Fer | Foi | 55 845 | 7 874 | 1,83 |
| 27 | Cobalt | Co | 58.9332 | 8.9 | 1,88 |
| 28 | Nickel | Dans | 58.6934 | 8 908 | 1,91 |
| 29 | Cuivre | Avec | 63 546 | 1.9 | 60 |
| 30 | Zinc | Zn | 65.39 | 1,65 | 70 |
| 31 | Gallium | Ici | 69 723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1,5 |
| 33 | Arsenic | Comme | 74.9216 | 2.18 | 1.8 |
| 3.4 | Sélénium | IL | 78,96 | 2,55 | 0,05 |
| 35 | Brome | Br | 79 904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83 798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85.4678 | 0,82 | 90 |
| 38 | Strontium | Sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | ET | 88 906 | 1.22 | 33 |
| 40 | Zirconium | Zr | 91 224 | 1,33 | 165 |
| 41 | Niobium | Nb | 92 906 | 1.6 | vingt |
| 42 | Molybdène | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Technétium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruthénium | Ru | 101.07 | 2.2 | 0,001 |
| Quatre cinq | Rhodié | RH | 102.91 | 2.28 | 0,001 |
| 46 | Palladium | PD | 106.42 | 2.2 | 0,015 |
| 47 | Argent | À | 107,87 | 1,93 | 0,075 |
| 48 | Cadmium | CD | 112 411 | 1,69 | 0,159 |
| 49 | Indium | Dans | 114,82 | 1,78 | 0,25 |
| cinquante | Croire | Sn | 118.71 | 1,96 | 23 |
| 51 | Antimoine | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Tellure | Le | 127,6 | 2.1 | 0,001 |
| 53 | Iode | je | 126.9045 | 2,66 | 0,45 |
| 54 | Xénon | Voiture | 131 293 | 2.6 | 3×10−5 |
| 55 | Césium | Cs | 132,91 | 0,79 | 3 |
| 56 | Baryum | Pas | 137 327 | 0,89 | 425 |
| 57 | Lanthane | La | 138,91 | 1.1 | 39 |
| 58 | Cérium | Ce | 140.12 | 1.12 | 66,5 |
| 59 | Praséodyme | Pr | 140.9077 | 1.13 | 9.2 |
| 60 | Néodyme | sd | 144.24 | 1.14 | 41,5 |
| 61 | Prométhium | PM | 145 | 1.13 | 2×10−19 |
| 62 | Samarium | Petit | 150,36 | 1.17 | 7.05 |
| 63 | Europium | UE | 151 964 | 1.2 | 2 |
| 64 | Gadolinium | D.ieu | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | tuberculose | 158.9253 | 1.2 | 1.2 |
| 66 | Dysprosium | Ceux | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | À | 164.9303 | 1.23 | 1.3 |
| 68 | Erbium | Est | 167 259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168.9342 | 1,25 | 0,52 |
| 70 | Ytterbium | Yb | 173.04 | 1.1 | 3.2 |
| 71 | Paris | Lu | 174 967 | 1.27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantale | Orienté vers | 180.9479 | 1,5 | 2 |
| 74 | Tungstène | DANS | 183,84 | 2.36 | 1.3 |
| 75 | Rhénium | Concernant | 186 207 | 1.9 | 7×10−4 |
| 76 | Osmium | Toi | 190.23 | 2.2 | 0,002 |
| 77 | Iridium | Et | 192.22 | 2.2 | 0,001 |
| 78 | Platine | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Or | Au | 196,97 | 2,54 | 0,004 |
| 80 | Mercure | Hg | 200,59 | 2 | 0,085 |
| 81 | Thallium | Tl | 204.3833 | 1,62 | 0,85 |
| 82 | Plomb | Pb | 207.2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismuth | Avec un | 208.9804 | 2.02 | 0,009 |
| 84 | Polonium | Après | 209 | 2 | 2×10−10 |
| 85 | Astatine | À | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radium | Soleil | 226 | 0,9 | 9×10−7 |
| 89 | Actinium | Et | 227 | 1.1 | 5,5×10−10 |
| 90 | Thorium | Ème | 232.0381 | 1.3 | 9.6 |
| 91 | Protactinium | Bien | 231.0359 | 1,5 | 1,4×10−6 |
| 92 | Uranium | DANS | 238.0289 | 1,38 | 2.7 |
| 93 | Neptune | Par exemple | 237 | 1,36 | ≤ 3×10−12 |
| 94 | Plutonium | Pu | 244 | 1,28 | ≤ 3×10−11 |
| 95 | Américium | Suis | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1,28 | – |
| 97 | Berkélium | BK | 247 | 1.3 | – |
| 98 | Californie | Cf. | 251 | 1.3 | – |
| 99 | Einsteinium | Est | 252 | 1.3 | – |
| 100 | fermium | FM | 257 | 1.3 | – |
| 101 | Mendeleïev | Maryland | 258 | 1.3 | – |
| 102 | noble | Non | 259 | 1.3 | – |
| 103 | Lawrencecium | G / D | 262 | 1.3 | – |
| 104 | Rutherfordium | RF | 267 | – | – |
| 105 | Dubnium | Base de données | 268 | – | – |
| 106 | Seaborgium | SG | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnérium | Mont | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Roentgénium | Rg | 282 | – | – |
| 112 | Copernic | CN | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flérovium | Dans | 290 | – | – |
| 115 | Moscovie | Mc | 290 | – | – |
| 116 | Livermorium | Niv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | Et | 294 | – | – |
Termes importants dans le tableau périodique
| Termes instanciation de Java | Description |
|---|---|
| Numéro atomique | Le nombre de protons qui constitue le noyau d’un élément est appelé son numéro atomique (Z). par exemple. Le carbone contient alors 6 protons, son numéro atomique ne doit donc être que 6. |
| Masse atomique | Elle est définie comme la masse moyenne des atomes d'un élément. Elle est mesurée sur la base de l’abondance naturelle relative des isotopes de l’élément. Masse atomique est également appelé poids atomique (A). Elle est mesurée en unité de masse atomique (amu). |
| Période | Les lignes horizontales de gauche à droite dans un tableau périodique sont appelées périodes. Il y a un total de 7 périodes dans le tableau périodique. Les éléments sont disposés horizontalement en raison de leurs similitudes de propriétés, comme les mêmes orbitales atomiques, etc. |
| Groupe | Les colonnes verticales de haut en bas d'un tableau périodique sont appelées groupes. Il y a un total de 18 groupes dans le tableau périodique. Les éléments sont disposés verticalement en raison de leurs similitudes de propriétés, car ils contiennent le même nombre d’électrons de valence. |
| Symbole d'un élément | Un symbole est une notion utilisée pour représenter un élément chimique à l'aide d'une lettre ou d'une combinaison de deux à trois lettres. par exemple. Le symbole chimique du carbone est C, tandis que Fe est utilisé pour le fer, etc. |
Classification des éléments dans le tableau périodique
Les 118 éléments sont répartis en 7 périodes et 18 groupes comme indiqué ci-dessus. De plus, les éléments sont divisés en différents blocs.
| Bloc | Éléments inclus | Dernière sous-couche électronique remplie |
|---|---|---|
| bloc s | Groupe 1 (métaux alcalins) | sous-shell s |
| Groupe 2 (métaux alcalino-terreux) | ||
| bloc p | Groupe 13 (Famille Bore) | sous-shell p |
| Groupe 14 (Famille Carbone) | ||
| Groupe 15 (Famille Azote) | ||
| Groupe 16 (Famille Oxygène) | ||
| Groupe 17 (Famille Fluor) | ||
| bloc d | Groupes 3 à 12 (éléments de transition) | sous-shell d |
| bloc f | Lanthanides (éléments de terres rares) | f-sous-shell |
| Actinides |
Tableau périodique de Mendeleïev
Afin de représenter les similitudes et les tendances dans le comportement des éléments, Mendeleïev a développé le tableau périodique, qui est un arrangement d'éléments dans un ordre croissant de masse atomique sous forme de tableau.

Selon le tableau périodique de Mendeleïev, les éléments étaient classés selon leurs propriétés fondamentales, leur masse atomique et leurs caractéristiques chimiques. Seuls 63 éléments étaient connus à l’époque des travaux de Mendeleïev. Dans le tableau périodique de Mendeleïev, les rangées horizontales et les colonnes verticales étaient respectivement appelées groupes et périodes.
Cependant, le tableau périodique de Mendeleïev échoue en raison de nombreux défauts. Certains d’entre eux sont qu’il n’a pas réussi à y désigner l’hydrogène et les gaz nobles. De plus, l’ordre croissant de la masse atomique des éléments n’était pas régulier tout au long du tableau. Même la découverte d’isotopes viole la loi périodique de Mendeleïev.
En savoir plus:
- Tableau périodique moderne
- Tableau périodique de Mendeleïev
- Droit périodique moderne
- Histoire du tableau périodique
- Structure atomique
FAQ sur le tableau périodique des éléments
Qu’est-ce que le tableau périodique des éléments ?
Le tableau périodique des éléments est un arrangement tabulaire d'éléments chimiques organisés par leur numéro atomique, leur configuration électronique et leurs propriétés chimiques récurrentes. Le tableau est divisé en lignes appelées périodes et en colonnes appelées groupes ou familles.
Qui a découvert le tableau périodique des éléments ?
Le tableau périodique des éléments n'a pas été découvert par une seule personne, mais son développement est attribué à Dmitri Mendeleïev, un chimiste russe, qui a organisé les éléments en fonction de leurs propriétés en 1869.
Qui a créé le tableau périodique moderne ?
En 1913, Henry Moseley a introduit une version mise à jour du tableau périodique, communément appelé tableau périodique moderne.
Comment est organisé le tableau périodique ?
Le tableau périodique est organisé par ordre de numéro atomique croissant, avec des éléments regroupés en fonction de propriétés chimiques similaires et disposés en périodes (lignes) et groupes (colonnes).
Qu'est-ce que le numéro atomique ?
Le nombre de protons qui constitue le noyau d’un élément est appelé son numéro atomique (Z). par exemple. Le carbone contient 6 protons donc son numéro atomique doit être 6 seulement.
Deux éléments différents peuvent-ils avoir le même numéro atomique ?
Le nombre de neutrons dans un atome provenant de deux éléments différents peut être similaire, mais le nombre de protons ne sera jamais le même. Chaque élément possède un nombre spécifique de protons, qui correspond au nombre d'atomes.
Comment calculer la masse atomique ?
La masse atomique peut être calculée en additionnant la masse des protons et des neutrons d’un élément.
Qu’est-ce qu’un groupe dans le tableau périodique ?
La colonne du tableau périodique fait référence au groupe du tableau périodique. Les éléments d'un même groupe ont des propriétés physiques et chimiques similaires.
