La notion de hybridation est défini comme le processus de combinaison de deux orbitales atomiques pour créer un nouveau type d’orbitales hybridées. Ce mélange aboutit généralement à la formation d’orbitales hybrides avec des énergies, des formes complètement différentes, etc. L'hybridation est principalement réalisée par des orbitales atomiques de même niveau d'énergie. Cependant, les orbitales entièrement remplies et à moitié remplies peuvent participer à ce processus si leurs énergies sont égales. Le concept d'hybridation est une extension de la théorie des liaisons de valence qui nous aide à comprendre la formation des liaisons, les énergies des liaisons et la longueur des liaisons.
Qu’est-ce que l’hybridation ?
Lorsque deux orbitales atomiques se combinent pour former une orbitale hybride dans une molécule, l’énergie des orbitales des atomes individuels est redistribuée pour donner des orbitales d’énergie équivalente. C’est ce qu’on appelle l’hybridation.
Les orbitales atomiques d'énergies comparables sont mélangées au cours du processus d'hybridation, qui implique principalement la fusion de deux orbitales ou de deux orbitales « p » ou le mélange d'une orbitale « s » avec une orbitale « p » ainsi qu'une orbitale « s ». orbitale avec un « d » orbital.
Orbitales hybrides sont les nouvelles orbitales formées à la suite de ce processus. Plus important encore, les orbitales hybrides peuvent être utilisées pour expliquer les propriétés de liaison atomique et la géométrie moléculaire. Le carbone, par exemple, forme quatre liaisons simples dans lesquelles l'orbitale s de la coquille de valence se combine avec trois orbitales p de la coquille de valence. Cette combinaison génère quatre sp équivalents3mélanges. Ceux-ci seront disposés selon un motif tétraédrique autour du carbone, qui est lié à quatre atomes différents.
Java vide
Étapes pour déterminer le type d’hybridation
Pour comprendre le type d’hybridation dans un atome ou un ion, les règles suivantes doivent être respectées.
- Tout d’abord, déterminez le nombre total d’électrons de valence contenus dans un atome ou un ion.
- Ensuite, comptez le nombre de paires libres attachées à cet atome ou à cet ion.
- Désormais, le nombre d'orbitales requis peut être calculé en additionnant le nombre de duplex ou d'octets et le nombre de paires d'électrons libres.
- Il convient de noter que la géométrie des orbitales des atomes ou des ions est différente lorsqu’il n’y a pas de paire d’électrons libres.
Caractéristiques de l'hybridation
- L'hybridation se produit entre des orbitales atomiques d'énergies égales.
- Le nombre d’orbitales hybrides formées est égal au nombre d’orbitales atomiques qui se mélangent.
- Il n’est pas obligatoire que toutes les orbitales à moitié remplies participent à l’hybridation. Même les orbitales complètement remplies mais dont l’énergie varie légèrement peuvent participer.
- L'hybridation ne se produit que lors de la formation de liaisons, et non dans un seul atome gazeux.
- Si l’hybridation de la molécule est connue, la forme de la molécule peut être prédite.
- Le plus grand lobe de l’orbitale hybride est toujours positif, tandis que le plus petit lobe du côté opposé est toujours négatif.
Les types d'hybridation
L'hybridation peut être classée comme sp3, sp2, sp., sp.3d, sp3d2, ou sp3d3basé sur les types d’orbitales impliquées dans le mélange.
sp Hybridation
Cela se produit lorsqu’une orbitale s et une orbitale p dans la coque principale d’un atome se combinent pour former deux nouvelles orbitales équivalentes. Les orbitales nouvellement formées sont connues sous le nom d’orbitales hybrides sp. Il produit des molécules linéaires selon un angle de 180°. Cela implique de combiner son orbitale et une orbitale « p » d’énergie égale pour produire une nouvelle orbitale hybride connue sous le nom d’orbitale hybride sp.
- C’est également ce qu’on appelle l’hybridation diagonale.
- Chaque orbitale hybride sp contient le même nombre de caractères s et p.
- Tous les composés du béryllium, tels que BeF2, Bien2, et BeCl2, en sont des exemples.

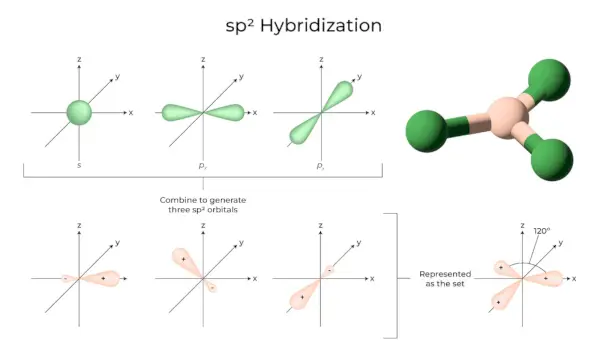
sp2Hybridation
Cela se produit lorsqu’une orbitale s et deux p de la coquille du même atome se combinent pour former trois orbitales équivalentes. Les orbitales nouvellement formées sont connues sous le nom de sp2orbitales hybrides. C’est également connu sous le nom d’hybridation trigonale. Cela implique de combiner son orbitale avec deux orbitales « p » d’énergie égale pour créer une nouvelle orbitale hybride connue sous le nom de sp.2. Un mélange de symétrie trigonale d’orbitales s et p est maintenu à 120 degrés. Les trois orbitales hybrides restent dans le même plan et forment entre elles un angle de 120°.
- Chaque orbitale hybride formée possède un caractère « p » de 33,33 % et de 66,66 %.
- Les molécules de forme planaire triangulaire ont un atome central qui est lié à trois autres atomes et est sp2hybridé. Les composés du bore en sont des exemples.
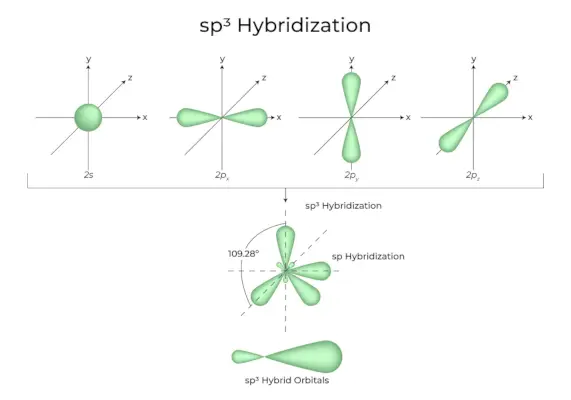
sp3Hybridation
Lorsqu'une orbitale « s » et trois orbitales « p » de la même coquille d'atome se combinent pour former quatre nouvelles orbitales équivalentes, l'hybridation est connue sous le nom d'hybridation tétraédrique ou sp.3. Les orbitales nouvellement formées sont connues sous le nom de sp3orbitales hybrides. Ceux-ci sont pointés aux quatre coins d’un tétraèdre régulier et forment entre eux un angle de 109°28′.
- Le sp3les orbitales hybrides forment un angle de 109,28 degrés.
- Chaque orbitale hybride a un caractère s à 25 % et un caractère p à 75 %.
- L'éthane et le méthane en sont deux exemples.
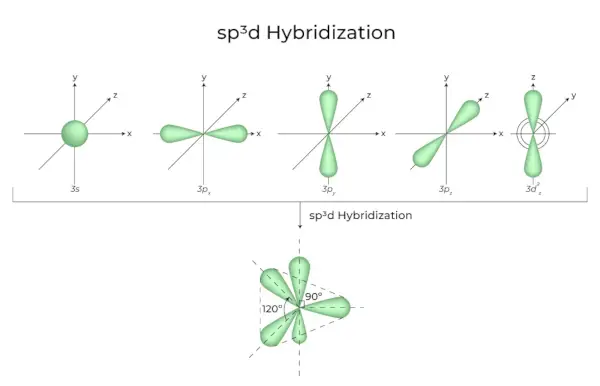
sp3d Hybridation
Le mélange d'orbitales 1s, d'orbitales 3p et d'orbitales 1d donne lieu à 5 orbitales hybridées sp3d d'énergie égale. Leur géométrie est bipyramidale trigonale. La combinaison des orbitales s, p et d aboutit à une symétrie bipyramidale trigonale. Les orbitales équatoriales sont trois orbitales hybrides orientées à un angle de 120° les unes par rapport aux autres et situées dans le plan horizontal.
- Les deux orbitales restantes, appelées orbitales axiales, se trouvent dans le plan vertical à 90 degrés des orbitales équatoriales.
- Hybridation dans le pentachlorure de phosphore par exemple (PCl5).
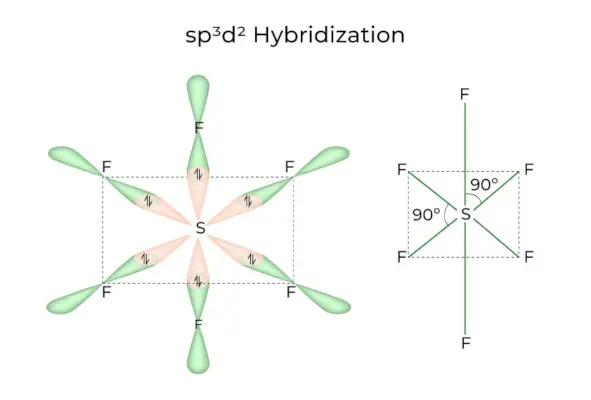
sp3d2 Hybridation
Lorsque les orbitales 1s, 3p et 2d se combinent pour former 6 sp identiques3d2orbitales hybrides, l'hybridation est appelée sp3d2Hybridation. Ces sept orbitales pointent vers les coins d'un octaèdre. Ils sont inclinés l’un par rapport à l’autre à un angle de 90 degrés.
idée complète
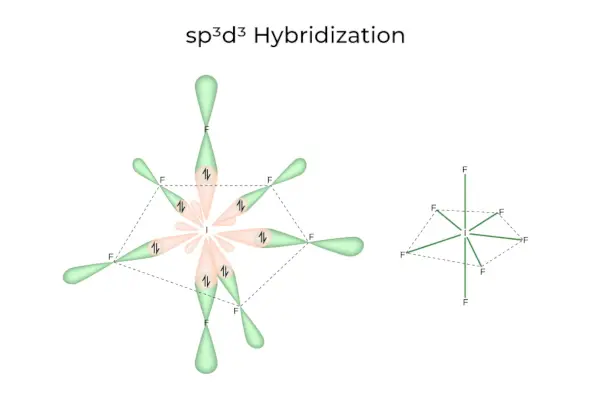
sp3d3Hybridation
Il possède des orbitales 1s, 3p et 3d, qui se combinent pour former 7 sp identiques3d3orbitales hybrides. Ces sept orbitales pointent vers les coins d’une bipyramidale pentagonale. par exemple. SI6.
Formes d’hybridation
- Linéaire : L'hybridation sp est provoquée par l'interaction de groupes à deux électrons ; l'angle orbital est de 180°. Plan trigonal : trois groupes électroniques sont impliqués, ce qui entraîne sp2hybridation; les orbitales sont espacées de 120°. Tétraédrique : quatre groupes électroniques sont impliqués, ce qui donne sp3hybridation; l'angle orbital est de 109,5°. Bipyramidal trigonal : cinq groupes électroniques sont impliqués, ce qui entraîne sp3d hybridation ; les angles orbitaux sont de 90° et 120°. Octaédrique : six groupes électroniques sont impliqués, ce qui entraîne sp3d2hybridation; les orbitales sont espacées de 90°.
FAQ sur Hybridation
Question 1 : Parmi sp, sp2 et sp3, quelle orbitale hybride est la plus électronégative ?
Répondre:
Le pourcentage du caractère s en sp, sp2, et sp3le carbone hybridé est respectivement de 50 %, 33,33 % et 25 %. En raison de la forme sphérique de l’orbitale s, elle est attirée uniformément de toutes les directions par le noyau. En conséquence, une orbitale hybride à caractère s sera plus proche du noyau et donc plus électronégative. En conséquence, le carbone hybride sp est le plus électronégatif.
Question 2 : Que sont les orbitales hybrides ?
Répondre:
comment télécharger une vidéo youtube vlc
Les orbitales hybrides sont formées en combinant des orbitales atomiques standard et aboutissent à la formation de nouvelles orbitales atomiques.
Question 3 : Quelles sont les cinq formes d’hybridation ?
avantages et inconvénients de la technologie
Répondre:
Linéaire, trigonal plan, tétraédrique, trigonal bipyramidal et octaédrique sont les cinq formes de base de l'hybridation.
Question 4 : Pourquoi la molécule amide ressemble-t-elle à sp3hybridé mais est sp2?
Répondre:
Si l’atome est entouré de deux ou plusieurs orbitales p ou possède une seule paire capable de sauter dans une orbitale p, le processus général d’hybridation changera. En conséquence, dans le cas d’une molécule amide, la paire isolée entre dans une orbitale p, ce qui donne lieu à trois orbitales p parallèles adjacentes.
Question 5 : Quelle est la règle de Bent ?
Répondre:
Un atome central connecté à de nombreux groupes dans une molécule s'hybridera, ce qui entraînera l'orientation des orbitales avec plus de caractère s vers des groupes électropositifs et des orbitales avec plus de caractère p vers des groupes électronégatifs.
